研究人员揭示了光合生物如何调节和合成ATP
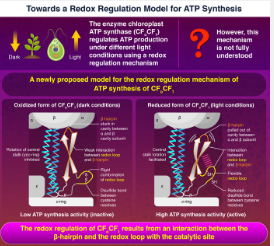
ATP 是植物、藻类和蓝藻等光合生物发挥功能所必需的化合物,由一种称为“叶绿体 ATP 合酶”(CF o CF 1 )的酶产生。为了在不同的光照条件下控制 ATP 的产生,该酶使用一种氧化还原调节机制来改变 ATP 合成活性,以响应半胱氨酸 (Cys) 残基氧化还原状态的变化,这些残基在还原(光照)条件下以二硫醇的形式存在,但形成氧化(黑暗)条件下的二硫键。然而,到目前为止,这种机制还没有被完全理解。
现在,在《国家科学院院刊》上发表的一项研究中,由东京工业大学(Tokyo Tech)的 Toru Hisabori 教授领导的日本研究小组揭示了氨基酸序列在CF o CF 1,揭示了该酶如何调节光合生物中 ATP 的产生。
为了解 CF o CF 1中氨基酸的构象如何影响氧化还原调节机制,研究人员使用单细胞绿藻莱茵衣藻来生产这种酶。“通过利用莱茵衣藻的强大遗传学作为光合作用的模式生物,我们对 CF o CF 1分子进行了全面的生化分析,”Hisabori 教授解释说。
以藻类为宿主生物,该团队引入了质粒(可以独立复制的染色体外 DNA 分子)编码CF o CF 1蛋白的 F 1成分,即含有 ATP 合成催化位点的酶部分。他们还引入了该基因的突变版本以改变蛋白质的氨基酸序列,特别针对 DDE 基序(一簇带负电荷的氨基酸)、氧化还原环和 β-发夹结构域。
然后他们纯化了 CF o CF 1,产生了它的五种不同变体,包括一种氨基酸序列没有变化的野生型菌株和四种突变菌株:一种 DDE 基序被中性氨基酸取代,Asn-Asn-Gln ,一种没有 β-发夹结构域,一种没有氧化还原环,一种同时缺乏氧化还原环和 β-发夹结构域。
在还原(模拟光照条件)和氧化(模拟黑暗条件)条件下测试这些突变体的 ATP 合成活性后,研究人员发现野生型酶和 DDE 基序发生变化的突变酶功能正常(显示还原时活性高,氧化时活性低)。然而,没有氧化还原环或 β-发夹结构域的酶复合物没有表现出氧化还原反应,表明这两个区域都参与了氧化还原调节机制。
研究人员提出,在黑暗条件下,Cys残基之间的二硫键使氧化还原环变得僵硬,削弱了氧化还原环与β-发夹之间的相互作用。这导致 β-发夹卡在蛋白质的空腔内。然而,当二硫键在光存在下被还原时,氧化还原环恢复其灵活性并将 β-发夹拉出空腔,使其能够参与 ATP 合成活动。
“ATP 合成的氧化还原调节是通过光合生物特有的CF o CF 1的两个 γ 亚基域之间的协同相互作用完成的,”Hisabori 教授说。“我们认为它是 β-发夹和氧化还原环与催化位点相互作用的结果。”
结果是更好地理解光合作用过程的重要一步,可能对农业和生物能源领域产生重大影响。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。