肾脏代谢的系统分析揭示了与病毒保护的意想不到的联系
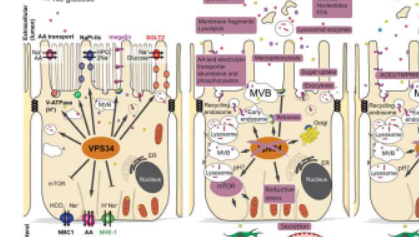
我们的肾脏每天过滤180升血液,并通过称为内吞作用的过程和肾细胞中的主动运输保留营养。在一项新的国际研究中,由奥胡斯高级研究所和奥胡斯大学生物医学系的MarkusRinschen领导的一个国际研究小组研究了这种内吞过程是如何被一种非常重要的酶——脂质激酶VPS34调节的,在小鼠中。这种脂质激酶参与囊泡运输和膜蛋白的内吞分选——这一过程对于身体获得正确的营养至关重要,同时也能阻止不健康的营养,如病毒。
多组学:组合多个数据集
研究人员应用了一种新的多组学方法,这种方法在分析过程中组合了多个数据集,以提供细胞生理学的全面视图。这种方法没有假设,但可以量化许多转运蛋白和酶的功能以及它们的相互作用——整个系统。
这项研究的多组学分析表明,小鼠近端小管细胞缺乏脂质激酶会降低细胞表面营养转运蛋白的丰度,这与脂质、氨基酸、糖和蛋白质的尿流失增加有关。此外,细胞表面病毒进入受体的数量也减少了。因此,用脂质激酶抑制剂治疗减少了SARS-CoV-2病毒进入培养的近端肾小管细胞和人肾类器官。
病毒感染的守门人:脂质激酶
该研究的结果表明,阻断酶脂质激酶可用于治疗限制营养物质保留具有临床益处的疾病,例如肾癌或糖尿病,或阻断肾脏的病毒感染。
“我们在这项研究中的主要目标是收集和组织细胞生理学基本过程的新知识。虽然这是无假设的,但这些全面的大规模数据集可以成为理解医学问题的核心。在这种情况下,我们最终改进了例如针对肾脏相关疾病或感染的靶向药物治疗,”该研究的第一作者、奥胡斯高级研究所和奥胡斯大学生物医学系副教授MarkusRinschen说。
“当然,在得出任何关于人类相关性的结论之前,需要收集更多的知识。”
这项工作发表在《科学信号》杂志上。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。