毒药帮助我们了解分子制氢生物催化剂
在自然界中,称为氢化酶的酶能够产生分子氢(H2)。这些特殊类型的生物催化剂,即所谓的[FeFe]-氢化酶,非常有效,因此对生物基氢生产很感兴趣。尽管科学家们已经了解了很多关于这些酶如何工作的知识,但仍有许多细节有待完全理解。
德国波鸿鲁尔大学光生物技术组以段吉福博士和ThomasHappe教授为首的研究团队成功填补了一项科学空白。研究人员表明,外部氰化物与[FeFe]氢化酶结合并抑制氢的形成。在此过程中,他们检测到质子传输路径的结构变化,这有助于理解电子和质子传输的耦合。他们在2022年12月4日的德国应用化学杂志上报告了他们的发现。
复杂的内部催化剂
为了产生H2,这些生物催化剂将电子转移到质子,采用复杂的结构作为内部催化剂。这种所谓的H团簇包含电子活性铁离子,这些铁离子与大多数人所知的毒素:一氧化碳和氰化物结合。
然而,尽管内部一氧化碳和氰化物对于氢化酶的高活性至关重要,但额外的外部一氧化碳会与H簇结合并阻止其产生H2。“有趣的是,氰化物也是一种众所周知的含铁生物催化剂抑制剂,”JifuDuan说。“然而,以前几乎没有分析过它对[FeFe]-氢化酶的影响。”
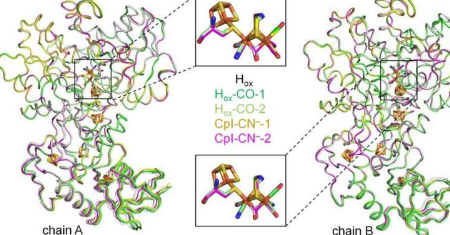
位于波鸿的研究团队填补了这一科学空白。研究人员表明,外部氰化物会结合并抑制[FeFe]-氢化酶。该团队与RUB蛋白质晶体学组组长EckhardHofmann教授合作,获得了与外部氰化物结合的H2生成生物催化剂的结构。
“高分辨率结构与光谱分析相结合告诉我们,外部氰化物直接与H簇结合,类似于迄今为止研究的其他抑制剂,”JifuDuan说。“这解释了为什么氢化酶在氰化物处理后没有活性。”
偶然捕获瞬态
当研究人员详细研究氰化物中毒的氢化酶的结构时,他们发现了一个惊喜。他们观察到质子传输路径的结构变化,这种变化是引导将成为H2的质子进入H团簇所需的结构变化。
“这种构象被认为对有效的质子穿梭至关重要,但从未在结构上观察到它。巧合的是,氰化物结合帮助我们捕捉到这种瞬态,”JifuDuan说。
“这些发现对于研究人员了解电子和质子传输的耦合非常重要,这不仅与H2生成酶相关,而且与许多其他生物催化剂相关,”ThomasHappe总结道。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。