突破性研究可以将干细胞疗法带给大众
加利福尼亚州SanaBiotechnology,Inc.的研究人员在实现干细胞治疗的前景方面取得了重大突破:干细胞不会引发免疫不相容的供体的免疫反应。
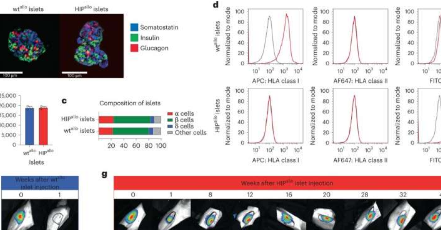
在NatureBiotechnology上发表的论文“低免疫诱导多能干细胞在完全免疫的同种异体恒河猴中长期存活”中,研究人员详细介绍了他们如何隐藏一系列低免疫多能(HIP)干细胞以逃避正常的排斥和破坏障碍用于治疗。
在实验环境中,低免疫多能细胞不会触发免疫细胞反应。它们也不受随同移植的野生型干细胞激发的细胞毒性的影响,成功逃避了直接检测和非目标威胁的影响。
HIP细胞在完全具有免疫能力的同种异体受体中不受限制地存活了16周(整个测试持续时间)并分化成几个谱系,而野生型细胞被强烈排斥。
在人源化糖尿病小鼠模型中,胰腺分化的人类HIP细胞持续了4周,并显示出病情改善的迹象。这些小鼠没有免疫抑制,也不是所用细胞类型的类型匹配。
对HIP细胞进行的另一项长期测试发现,在植入恒河猴受体40周后,细胞胰岛没有免疫抑制,而未经编辑的野生型版本在一周内被破坏。
干细胞有可能彻底改变医学,因为它们可以被操纵以分化成各种细胞类型,使它们成为用于移植或再生医学的有前途的新细胞来源。通过将干细胞引入受损组织或器官,有可能再生健康组织并恢复正常功能。这对开发针对各种疾病的新疗法具有重要意义,包括癌症、心脏病和神经系统疾病。
人类诱导多能干细胞(hiPSC)于2007年由日本京都大学的KazutoshiTakahashi及其同事首次创建。从那时起,研究人员一直致力于寻找释放这些干细胞治疗应用潜力的方法,但一些障碍减缓了它们在临床上的广泛应用。
干细胞可以像任何细胞类型一样增殖,产生新鲜的无病组织。然而,这些自我维持的细胞有可能在移植后继续增殖,增殖为不正确的组织,或包含具有脱靶相互作用的遗传变异,所有这些都可能导致肿瘤。随着干细胞从研究环境转向更集中的临床应用,这个问题可能在细胞系选择和管理、细胞信号转导和其他基因组因素方面有直接的基于知识的解决方案。
另一个问题是人类白细胞抗原(HLA),这是在大多数细胞上发现的标记物,免疫系统使用这些标记物来区分天然细胞和侵入性细胞,从而使侵入性细胞成为破坏的目标。人类有数以千计的HLA变体,然后需要对干细胞进行改造以匹配每个人,这是一个可行的过程,但无法扩展到大规模治疗。如果没有紧密匹配,免疫系统将消除引入宿主的干细胞。
大众干细胞
拥有数万个HLA干变体和数百万个细胞的库是解决该问题的一种非常不可行的方法。如果这是唯一的选择,我们可以用当前的技术来做到这一点,并且最终将通过一条充满善意的道路的漫长而昂贵的旅程来实现。
更可行的解决方案是HLA伪装方法,它仍然可以保留。只需对少数功能性干细胞系进行编辑,使其隐藏在免疫系统的视线范围内,就可以开发出一组通用的供体干细胞。此外,这种方法将更容易研究,加速我们对一些多功能产品线的理解,并允许简化临床试验和监管批准治疗。
SanaBiotechnology使用的成功方法可能正是科学研究界所缺少的。允许在非免疫抑制患者中使用无与伦比的HLA,克服了说明干细胞疗法潜在未来的大量研究论文与革命性医学的常规应用之间的许多障碍。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。