研究人员描述了扭曲的细胞细胞粘附分子复合结构
我们的身体由不同的组织和器官组成,这些组织和器官由许多细胞组成,这些细胞必须粘附才能形成功能性的高阶结构。这种粘附是由称为细胞 - 细胞粘附分子的特殊蛋白质促进的,这些蛋白质从邻近细胞延伸并相互连接。
一类细胞-细胞粘附分子是钙粘蛋白EGF LAG七通道G型受体(CELSR)钙粘蛋白。这些蛋白质在形成具有特定细胞形状和模式的组织方面起着重要作用。迄今为止,我们并不完全了解CELSR钙粘蛋白的结构和功能。
ExCELLS的Shigetaka Nishiguchi,岐阜大学iGCORE的Kasai S. Rinshi以及ExCELLS和名古屋大学的Takayuki Uchihashi利用单分子荧光显微镜和高速原子力显微镜(HS-AFM)阐明了CELSR钙粘蛋白二聚化的机制。
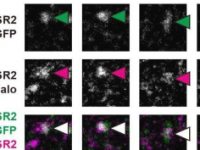
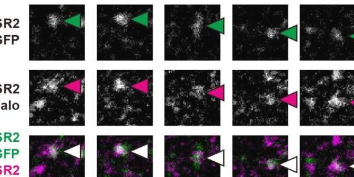
研究人员构建了两种不同的荧光标记的CELSR钙粘蛋白(CELSR2-mGFP和CELSR2-Halo),并使用单分子荧光显微镜观察表达CELSR2-mGFP或CELSR2-Halo的相邻细胞之间的界面(图1A)。
他们的结果表明,细胞-细胞界面处两种不同标记的CELSR钙粘蛋白的共定位荧光斑点在长距离(~1μm)和时间(~1秒)以上持续存在,表明CELSR钙粘蛋白形成特异性和稳定的二聚体以连接相邻细胞以形成最小粘附单元。
接下来,他们使用HS-AFM在纳米尺度的溶液中获得纯化的CELSR钙粘蛋白的高分辨率图像(图1B)。图像显示,连接细胞的CELSR钙粘蛋白的细胞外结构域(外结构域)分别表现出由钙粘蛋白外域和非钙粘蛋白外结构域组成的链状和小球状部分。
HS-AFM还揭示了两种CELSR钙粘蛋白通过反平行方向的链状结构结合,与使用单分子荧光显微镜观察到的细胞之间CELSR钙粘蛋白的结合复合物一致。这些研究人员应用了其他研究人员先前开发的HS-AFM图像的定位分析,以提高其HS-AFM图像的空间分辨率并获得更高分辨率的结构图像。
他们的分析表明,CELSR钙粘蛋白的八个钙粘蛋白外域的链状部分完全以扭曲的方式重叠。这些研究人员还证明,来自CELSR钙粘蛋白膜远端侧的第四个钙粘蛋白外域对于使用磁珠聚集测定的CELSR钙粘蛋白相互作用尤为重要,该测定可以评估CELSR钙粘蛋白结合活性。
有趣的是,本研究中报告的结合复合物中八个钙粘蛋白外结构域的重叠是迄今为止描述的相对于其他钙粘蛋白成员的最广泛的相互作用,并且CELSR钙粘蛋白复合物比上皮细胞细胞-细胞粘附区的典型细胞外空间距离(66-7 nm)大(~15.25 nm)。
研究人员假设,CELSR钙粘蛋白形成的大结合复合物可能充当细胞之间的物理间隔物,为含有信使分子的小细胞外囊泡留出空间,并调节极性依赖性组织形成,这直接影响细胞的模式。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。