在人类中发现隐藏的RNA修复机制
核糖核酸(RNA)是单链分子,在所有活生物体的细胞中起着至关重要的作用。例如,作为我们基因的“转录本”,mRNA通过在它们自己的序列中携带用于创建蛋白质的指令,从而参与遗传信息的翻译。康斯坦茨大学有机和细胞化学教授AndreasMarx解释说:“为了在细胞中发挥不同的功能,RNA在产生后通常需要进行化学修饰或在受损后进行修复。”
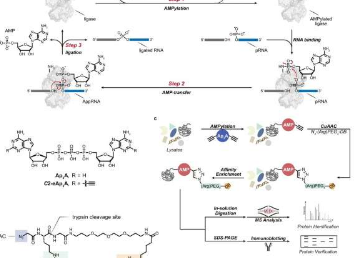
在这里发挥作用的一种化学反应是两条RNA链在其各自相对末端的三步连接(连接)。这种反应由称为RNA连接酶的特殊酶触发,存在于从病毒到真菌和植物的所有生命形式中。在包括人类在内的脊椎动物中,这种RNA连接酶尚未被发现。
康斯坦茨的一个跨学科研究小组现在发现了第一个这种类型的人类RNA连接酶,蛋白质C12orf29。在细胞水平上,发表在NatureCommunications上的研究结果表明该酶具有抵抗细胞应激的保护功能。
我们细胞的抗氧化防御系统
“我们在对人类肺癌和肾细胞的广泛研究中注意到了C12orf29,我们在这些研究中寻找具有特定化学特征的蛋白质,并为此使用了新的化学工具。它引起了我们的注意,因为直到那时我们才了解蛋白质的功能是,”马克思说。
因此,研究人员开发并使用了各种方案来纯化和预测未探索蛋白质的结构,并进行实验以追踪其化学功能。因此,他们能够证明最初只是一个合理的怀疑:C12orf29使用三磷酸腺苷(ATP)连接RNA链。
研究人员能够详细证明这一过程遵循一种特征性的三步反应模式,这种模式从其他生命形式的其他RNA连接酶中已知。为了在细胞水平上更多地了解C12orf29的功能,研究人员在阐明化学机制后更进一步。
“我们使用CRISPR/Cas基因剪刀生成了一系列人类肾细胞,其中编码C12orf29的基因被敲除。然后我们能够在不同的实验条件下将这些敲除(KO)细胞与‘正常’肾细胞进行比较,"马克思解释道。
特别是,当用甲萘醌(一种维生素K)处理细胞时,在KO细胞和具有功能性RNA连接酶的野生型细胞之间观察到明显差异:相对低浓度的甲萘醌足以损伤KO细胞。相反,野生型细胞仅在显着更高的浓度下受损。
由于已知甲萘醌会引起氧化应激,研究人员从这一结果得出结论,C12orf29可防止细胞氧化应激。“我们假设以前隐藏的人类RNA修复机制是C12orf29的这种生物学功能的基础。我们现在需要在进一步的研究中检查这种机制,”马克思说。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。