研究团队确定了新的mtDNA编辑工具
北京大学未来技术学院王阳明实验室的一组研究人员最近从Simiaoasunii(Ddd_Ss)中鉴定出一种DddA同源物,它可以在双链DNA(dsDNA)的DC环境中有效地脱氨基胞嘧啶。他们的发现于2023年2月16日发表在NatureCommunications上,标题为“DddAhomologsearchandengineeringexpandsequencecompatibilityofmitochondrialbaseediting”。
碱基编辑是一种向目标DNA序列引入突变的精确方法,可用于研究基因和调控元件、疾病建模以及开发遗传病治疗方法。虽然核DNA的碱基编辑已通过成簇的规则间隔短回文重复序列(CRISPR)衍生碱基编辑器实现,但同样的方法不适用于线粒体DNA(mtDNA)编辑,因为难以将引导RNA递送到线粒体中。
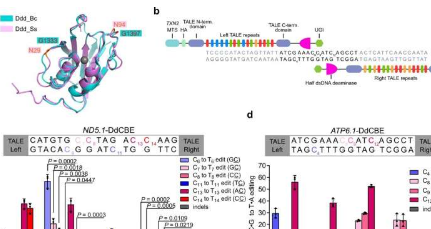
研究人员一直在使用转录激活因子样效应子(TALE)衍生的碱基编辑器DdCBE和TALED来催化mtDNA中的C-to-T和A-to-G编辑。这些方法依赖于DddAtox,一种来自新洋葱伯克霍尔德氏菌(Ddd_Bc)的dsDNA脱氨酶。然而,原始的Ddd_Bc需要严格的TC序列上下文,这使得它不适合作为GC上下文目标。此外,尚不清楚是否可以在其他物种中发现更多的dsDNA脱氨酶。
为了解决这些问题,本研究中的研究人员确定并设计了可用于开发高效碱基编辑工具的dsDNA脱氨酶同系物。他们从Simiaoasunii(以中国唐朝(618-907年)伟大的医学家孙思邈的名字命名)中发现了一种双链DNA脱氨酶,该酶具有高活性和广泛的序列相容性。基于这一发现,他们开发了高效的碱基编辑工具这可能会在多个mtDNA位点引入突变,包括以前无法访问的GC上下文中的疾病相关突变。他们还通过从Ddd_Ss引入单个氨基酸取代来提高DdCBE_Bc的活性和序列相容性。
研究人员的结果表明,Ddd_Bc的C端包含两个SPKK相关肽基序,它们更喜欢在dsDNA的小沟中结合富含A/T的DNA序列。删除这些基序消除了Ddd_Bc的dsDNA脱氨酶活性。然而,添加具有与SPKK相关基序相似的DNA结合特性的AT钩可以恢复截短的Ddd_Bc的脱氨酶活性。C端肽中脯氨酸突变为缬氨酸或天冬酰胺会降低或完全消除Ddd_Bc的脱氨酶活性,表明Ddd_BcC端SPKK相关基序对其dsDNA脱氨活性的重要性。
这项研究扩展了线粒体碱基编辑器的序列兼容性,但未来需要更复杂的设计来实现高效和高度特异性的编辑。
李米,博士北京大学未来技术学院学生,石铭,博士。北京大学-清华大学生命科学联合中心的学生,是该论文的共同第一作者。该研究得到了北京大学易成奇、高宁、魏文生、程和平、王先华和陈良义实验室的指导和协助。新发现的双链脱氨酶相关应用的专利申请也已提交。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。