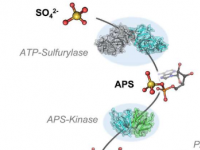
Nanobiotics用于发现纳米粒子在何处以及如何与蛋白质结合的AI
确定纳米颗粒和蛋白质是否以及如何相互结合是朝着能够按需设计抗生素和抗病毒药物迈出的重要一步,密歇根大学开发的计算机模型可以做到这一点。
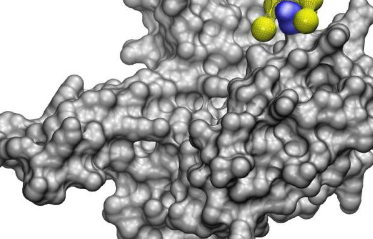
这种新工具可以帮助找到阻止抗生素耐药性感染和新病毒的方法,并有助于设计用于不同目的的纳米粒子。
“仅在2019年,死于抗生素耐药性的人数就为495万。即使在使问题恶化的COVID之前,研究表明,到2050年,抗生素耐药性导致的死亡人数将达到1000万,”AngelaVioli说,ArthurF.Thurnau机械工程教授,以及登上《自然计算科学》封面的研究的通讯作者。
“在我的理想情况下,从现在起20或30年,我希望——给定任何超级细菌——能够快速生产出可以治疗它的最好的纳米颗粒。”
细胞内的大部分工作都是由蛋白质完成的。它们表面的相互作用位点可以将分子缝合在一起、将它们分开并进行其他修饰——打开进入细胞的通道、分解糖分以释放能量、构建结构以支持细胞群等等。如果我们能够设计出针对细菌和病毒中关键蛋白质的药物而不伤害我们自己的细胞,那将使人类能够快速对抗新的和不断变化的疾病。
名为NeCLAS的新模型使用机器学习——为智能手机和ChatGPT上的虚拟助手提供支持的人工智能技术。但它不是学习处理语言,而是吸收蛋白质的结构模型及其已知的相互作用位点。从这些信息中,它学会推断蛋白质和纳米粒子如何相互作用,预测结合位点和它们之间结合的可能性——以及预测两种蛋白质或两种纳米粒子之间的相互作用。
“存在其他模型,但我们的模型是预测蛋白质和纳米颗粒之间相互作用的最佳模型,”密歇根大学机械工程副研究员PaoloElvati说。
例如,AlphaFold是一种广泛使用的工具,用于根据称为氨基酸的构建单元预测蛋白质的3D结构。虽然这种能力至关重要,但这仅仅是个开始:下一步是发现这些蛋白质如何组装成更大的结构并设计实用的纳米级系统。
“这就是NeCLAS的用武之地,”密歇根大学化学工程博士生、该研究的第一作者JacobSaldinger说。“它超越了AlphaFold,展示了纳米结构如何相互作用,而且它不仅限于蛋白质。这使研究人员能够了解纳米粒子的潜在应用并优化他们的设计。”
该团队测试了三个案例研究,他们有额外的数据:
分子镊子,其中一个分子与另一个分子的特定位点结合。这种方法可以阻止有害的生物过程,例如阿尔茨海默氏症等大脑疾病中蛋白质斑块的聚集。
石墨烯量子点如何分解葡萄球菌产生的生物膜。这些纳米粒子是碳薄片,厚度不超过几个原子层,边长为0.0001毫米。分解生物膜可能是对抗抗生素耐药性感染的重要工具——包括通常在医院感染的超级细菌耐甲氧西林金黄色葡萄球菌(MRSA)。
石墨烯量子点是否会分散在水中,证明该模型具有预测纳米粒子-纳米粒子结合的能力,即使它只接受了蛋白质-蛋白质数据的训练。
虽然许多蛋白质-蛋白质模型将氨基酸设置为模型必须考虑的最小单位,但这不适用于纳米粒子。相反,该团队将最小特征的大小设置为大致与氨基酸的大小相同,然后让计算机模型决定这些最小特征之间的边界在哪里。结果是蛋白质和纳米粒子的表示看起来有点像相互连接的珠子的集合,为探索小规模相互作用提供了更大的灵活性。
“除了更通用之外,NeCLAS使用的训练数据也比AlphaFold少得多。我们只有21个纳米粒子可供观察,因此我们必须以巧妙的方式使用蛋白质数据,”密歇根大学电气和计算机工程博士生MattRaymond说。和研究合著者。
接下来,该团队打算探索其他生物膜和微生物,包括病毒。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。