研究人员确定了PAPPA的三维结构
丹麦研究人员已经确定了蛋白水解酶PAPP-A的三维结构。这些结果可能让我们更好地了解调节脊椎动物线性生长的基础生物学。相同的调节机制也涉及几种与年龄相关的疾病,因此,该研究是朝着开发新型药物迈出的重要一步。
生长因子IGF在人类生长中起着关键作用。在没有IGF信号的情况下,我们变成了侏儒。在以后的生活中,IGF参与与年龄相关的疾病,例如癌症和心血管疾病。在这两种情况下,IGF都必须从非活性形式转变为活性形式。这就是PAPP-A能够做到的。
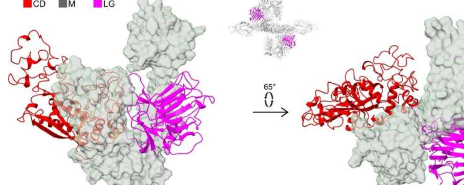
“七年前我们发现蛋白质STC2阻断了PAPP-A的活性,从而间接抑制了IGF生长因子的活性。为了阻断活性,STC2必须与PAPP-A形成复合物。我们研究过这种复合物,我们现在知道了它的三维结构,”克劳斯·奥克斯维格教授解释道。
“看到一个分子,我们在生化方面非常了解,实际上看起来是什么样子是令人着迷的。PAPP-A是心形的,有一个内部‘腔’。但从研究的角度来看,形状并不是最有趣的特征.相反,它是分子不同元素之间的相互作用。
关于调节有多少IGF转化为活性形式的分子机制仍有许多悬而未决的问题。PAPP-A和STC2之间的复合物形成很可能受到高度调节。这种假设得到了早期研究结果的支持,该研究结果表明,仅取代一个氨基酸的STC2人类天然变体与PAPP-A形成复合物的速度稍慢。这样做的结果是PAPP-A可以激活稍微多一点的IGF,导致高度增加高达2.1厘米。
报告PAPP-A·STC2结构的出版物的第一作者、研究生SaraDamKobberø使用低温电子显微镜(cryo-EM)确定了大蛋白质复合物的结构。丹麦国家冷冻电镜研究基础设施(EMBION,AU)允许进行这项研究,该研究还涉及哥本哈根大学的参与者。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。