非人类灵长类动物的成功低温为未来在太空飞行期间应用于人类麻木铺平了道路
冬眠是某些哺乳动物为了适应恶劣的冬季条件而采用的一种状态。冬眠的典型特征包括新陈代谢活动大大减少和体温降低。
作为温血动物,灵长类动物(狐猴除外)不会自然冬眠,甚至不会感到麻木。但我们能否操纵灵长类动物的体温,让它们陷入低代谢状态甚至人工冬眠呢?
中国科学院深圳先进技术研究院(SIAT)王宏博士和戴季博士领导的研究团队最近报告了首次通过激活一组下丘脑神经元引起的非人灵长类动物的可靠体温过低。
该研究发表在TheInnovation上。
研究人员通过结合化学遗传学操作、功能性磁共振成像(fMRI)扫描、行为分析以及对一整套生理和生化参数的监测,探索了非人灵长类食蟹猴的体温调节。
“为了研究视前区(POA)激活导致的全脑网络,我们进行了fMRI扫描,并确定了涉及体温调节和内感受的多个区域,”通讯作者之一戴博士说。“这是第一项fMRI研究,旨在研究化学遗传激活所揭示的全脑功能联系。”
研究人员通过用由CAMKII启动子驱动的DREADD编码病毒局部感染神经元,选择性地靶向猴脑下丘脑POA中的兴奋性神经元。“DREADD”是指专门由设计药物激活的设计受体。他们发现同源DREADD激动剂氯氮平N-氧化物(CNO)对POA神经元子集的激活可靠地触发了麻醉和清醒猴子的体温过低。
在麻醉实验中,令人惊讶的是,CNO诱导的神经元活动导致核心体温降低,从而对抗外部加热。这表明POA中进化上保守的兴奋性神经元在功能上也是保守的,并且在灵长类动物大脑的温度调节中起着关键作用。
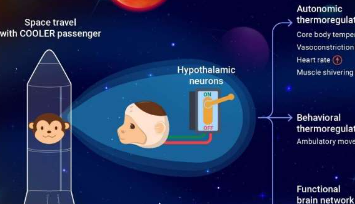
研究人员在猴子模型中检查了对诱导低温的自主神经和行为反应。与通常减少活动和降低心率的小鼠相比,猴子通过提高心率、颤抖骨骼肌和增加运动来保护体温。所有数据都表明灵长类动物的体温调节机制比老鼠更复杂。解剖学上保守的细胞类型可能在它们的连接和功能上有所不同。
“这项工作首次成功展示了基于靶向神经元操作的灵长类动物体温过低,”Wang博士说。“随着人类对太空飞行的热情越来越高,这种低温猴子模型是通往人工冬眠的漫长道路上的一个里程碑。”
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。