解开微管生长的奥秘Kip2和Bik1的复杂舞蹈
在最近发表在《细胞生物学杂志》上的一项多学科研究中,Barral小组(D-BIL/IBC)与Steinmetz小组(PSI)和Stelling小组(D-BSSE)一起阐明了驱动蛋白Kip2的运动域如何与微管加末端结合蛋白Bik1合作,作为微管聚合酶。

驱动蛋白是微管依赖性运动蛋白,以其在沿微管运输货物中的作用而闻名。现在发表在JCB上的研究结果改变了我们对其中一些运动蛋白如何控制微管细胞骨架组织的理解。
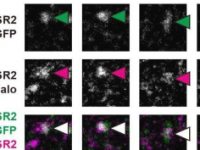
作者展示了Kip2(一种细胞质驱动蛋白)如何促进微管生长和稳定。先前的研究表明,缺乏KIP2基因的细胞形成较短且丰度较低的星体微管。有趣的是,Kip2在体内的微管稳定功能取决于细胞质接头蛋白Bik1的存在,Bik1是后生动物CLIP-170的酵母直系同源物。
这项新研究表明,Kip2促进微管聚合的能力有两个关键结构元素:除了微管轴外,运动域中专用于结合游离微管蛋白的相互作用界面,以及细胞质接头蛋白Bik1在其C末端尾部的结合位点。虽然游离微管蛋白相互作用界面不参与Kip2沿微管的运动,但它在微管聚合中起着至关重要的作用。
另一方面,Bik1的结合位点以Bik1依赖性的方式增加了Kip2在活细胞中微管加末端的停留时间。
基于他们的发现,研究人员现在已经开发出Kip2如何促进体内微管聚合的模型。他们认为,当Kip2通过其运动易位到达微管的最末端时,Kip2的自由运动域结合游离微管蛋白并促进其掺入原丝中。换句话说,Kip2一旦到达微管尖端,可能会在其“脚”下延伸自己的轨道。
尽管需要更详细的机制研究来解决这种可能性,但游离微管蛋白结合界面在运动域中的位置表明,微管蛋白二聚体在细长微管末端的递送和释放与在运动过程中介导轴上微管蛋白结合和释放的机制相同,即取决于Kip2的ATP酶循环。这一观点与先前的观察结果一致,表明ATP水解对于Kip2促进微管生长至关重要。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。