研究发现番茄根缺铁时DNA甲基化组和RNA转录组之间存在联系
番茄(Solanumlycopersicum)是最重要的园艺作物之一,富含铁和维生素。作为植物必需的微量元素,铁(Fe)缺乏不仅限制番茄的生长、发育和果实品质,而且对动物和人类造成健康风险,导致全球范围内的人类营养失调。
虽然植物对缺铁反应的转录和转录后机制已被广泛研究,但表观遗传调节(例如DNA甲基化)的贡献仍然知之甚少。在这里,我们报道了DNA甲基化组和RNA转录组之间的联系,以响应番茄根中短期(12小时)和长期(72小时)铁缺乏。
通过结合甲基化组分析和遗传学方法,我们提出bHLH39启动子CG背景下的动态表观遗传DNA甲基化参与其转录调控,从而有助于番茄缺铁诱导的反应。
文章“bHLH39启动子的CG高甲基化调节其表达和番茄根部铁缺乏反应”已发表在《园艺研究》上。
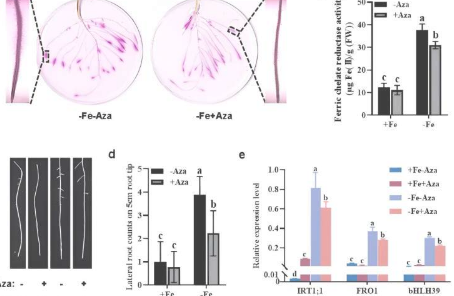
首先,利用DNA甲基化酶抑制剂5-氮杂胞苷(Aza)来研究其对番茄缺铁诱导反应表达的影响。如图1所示,外源施用Aza极大地抑制了根部FCR活性的诱导,缺铁诱导的根部形态发育和三个核心基因(IRT1;1、FRO1和bHLH39)的转录水平也受到抑制,这表明DNA甲基化在调节缺铁反应中的重要性。
随后,DNA甲基化和基因表达的动态变化发现,超差异甲基化区域(DMR)的数量随着时间的推移而增加,特别是在CG和CHG背景下,这伴随着Fe缺乏诱导基因的转录水平更高(图2a、b)。
此外,我们发现在短期或长期治疗下,DNA甲基化水平的变化与受影响基因转录水平的变化之间没有明显的相关性,除了一些核心Fe缺乏诱导的基因,即bHLH39之外。、bHLH18、Nramp1、OPT3和FRO4,其表达变化与长期治疗下的DNA甲基化变化有一定关系(图2c,d)。
值得注意的是,bHLH39启动子中CG位点的高甲基化程度高于低甲基化程度,这与长期缺铁治疗诱导bHLH39表达有关(图2e、f)。一致地,与野生型幼苗相比,我们在MET1−RNA干扰系中检测到bHLH39启动子处的CG甲基化较低,bHLH39表达较低,但失绿表型更严重(图2g-i),这进一步证实了启动子CG甲基化之间的正相关性和基因转录。
总之,我们揭示了DNA甲基化和转录组的动态,这对于缺铁引起的番茄根反应非常重要。
此外,CG背景下的DNA甲基化与基因表达呈正相关,并介导特定基因的转录,例如bHLH39,它有助于番茄根部的铁缺乏反应。该研究结果将丰富我们对植物缺铁调控机制的认识,并为作物改良提供理论和技术支持。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。