揭示内吞作用和细胞内运输的新机制
内吞作用是细胞内化水和营养物质等物质的重要细胞过程。这些物质首先作为货物运输到初始分选室(内体),然后被降解(内溶酶体途径)或回收(质膜的回收途径)。
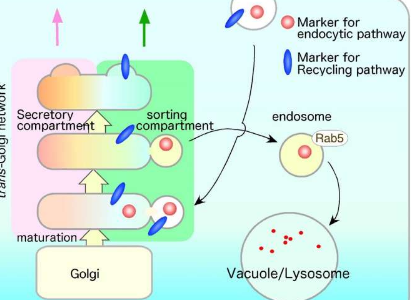
跨高尔基体网络(TGN)位于高尔基体附近,是这种细胞内运输的关键介质。内吞作用介导细菌和病毒等有害病原体的感染,其破坏可能导致多种疾病。因此,了解控制这一过程的分子机制至关重要。芽殖酵母是研究内吞作用的重要模型,但这些生物体中内吞货物分选的具体机制长期以来仍不清楚。
2023年7月21日发表在《eLife》杂志上的一项研究发现了芽殖酵母中的一种新的内吞途径。研究结果表明,TGN内的一个特定区室(由一种名为Tlg2p的蛋白质标记)充当早期区室,对内吞货物进行分类以进行回收或降解。
这些令人兴奋的发现是一大批杰出研究人员之间重大国际合作的结果,其中包括东京理科大学生物科学与技术系的JiroToshima教授、健康科学学院的JunkoYToshima教授、东京工业大学、奥地利科学技术研究所的DariaESiekhaus教授和RIKEN先进光子学中心的AkihikoNakano博士。
“不同类型的生物体(如植物和动物)的内吞分选机制有所不同。我们的研究结果回答了一个长期存在的问题,即酵母作为内吞作用的常见模型生物体,在内吞途径的早期是否拥有特定的分选室,”教授解释道。丰岛。
这一发现的关键工具是荧光内吞标记物,该标记物先前由Toshima教授和他的同事开发。结合使用由Nakano博士小组(RIKEN,Wako)开发的高灵敏度超分辨率共焦实时成像显微镜(SCLIM)进行的高速4D成像,该工具使研究人员能够观察内吞货物的动态。
使用这种方法的微观结构研究表明,内吞作用后,荧光内吞作用标记物首先被TGN中特定的、独立的区室吸收。重要的是,这个区室含有Tlg2p,它是内吞囊泡的靶蛋白。
值得注意的是,发现注定要被溶酶体降解并被质膜回收的物质和蛋白质首先定位于相同的Tlg2p区室。这些发现表明,该分选室将内吞货物材料发送至溶酶体进行降解,并发送至质膜进行回收。研究小组还发现,高尔基体相关的、含有γ-适应素耳的Arf结合(GGA)蛋白是这种分选机制需要的接头蛋白。
进一步分析表明,同一TGN内Tlg2p驻留区室与分泌区室在空间上不同,表明其在细胞内独立存在。此外,虽然GGA的删除影响了Tlg2p驻留区室的分选动力学,但它对分泌区室没有影响。总之,这些发现表明不同的TGN区室可能参与分泌和内吞分选。
本研究中发现的新内吞机制表明哺乳动物细胞中存在类似的运输途径(区室)。因此,它们可能是揭示基本生命过程的分子机制以及内吞作用破坏引起的感染和疾病机制的关键。
Toshima教授阐述道:“我们的研究结果具有临床转化的潜力。将来,它们可用于开发治疗策略,以预防/治疗病原体感染和内吞性疾病引起的其他疾病。鉴于出现了新的病原体,预计未来只会增加。”
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。